Комиссия «ОПОРЫ РОССИИ» по обращению медицинских изделий провела очередное заседание
18 апреля состоялось заседание Комиссии «ОПОРЫ РОССИИ» по обращению медицинских изделий. В заседании приняли участие представители субъектов системы обращения медицинских изделий (МИ), в том числе Минпромторга России, Минздрава России, Росздравнадзора, ФГУ «Институт медицинских материалов», а также компаний производителей МИ и отраслевых объединений предпринимателей. Эксперты обсудили на встрече такие вопросы, как: новая редакция постановления Правительства РФ от 27 декабря 2012 г. №1416 «Об утверждении Правил государственной регистрации медицинских изделий»; правоприменительная практика системы льготного налогообложения для МИ; опыт эксперимента по маркировке средствами идентификации отдельных видов радиоэлектронной продукции в части комплектующих и запасных частей для МИ; перспективы перехода системы государственной регистрации МИ на единые Правила ЕАЭС.
Мероприятие открыл Вице-президент Ассоциации «НП «ОПОРА», Председатель Комиссии «ОПОРЫ РОССИИ» по обращению медицинских изделий Станислав Гольдберг, который выразил позицию бизнес-сообщества о необходимости дальнейшего развития законодательства в части совершенствования системы обращения МИ.
Эксперт сообщил, что Рабочая группа при Правительстве РФ по реализации механизма регуляторной гильотины по фармацевтике и медицинским изделиям готова, при учете ключевых замечаний в короткие сроки, согласовать новую редакцию ПП РФ №1416.
В свою очередь, представители регуляторных органов отметили, что в новой редакции указанного постановления учтены множество предложений и замечаний бизнес-сообщества. В частности, оптимизирована процедура регистрации МИ, упорядочен перечень заявительной документации и др.
Представитель Минздрава России также сообщил, что проект новой редакции ПП РФ №1416 в ближайшее время будет вынесен на обсуждение Рабочей группы в рамках Регуляторной гильотины, и, в случае отсутствия существенных разногласий, в мае 2024 года может быть внесен в Правительство России. Вместе с тем, по мнению представителей отрасли МИ, вероятность принятия документа до конца мая 2024 года представляется низкой, поэтому срок вступления новых правил в силу может быть перенесен с 1 сентября 2024 года на 1 марта 2025 года.
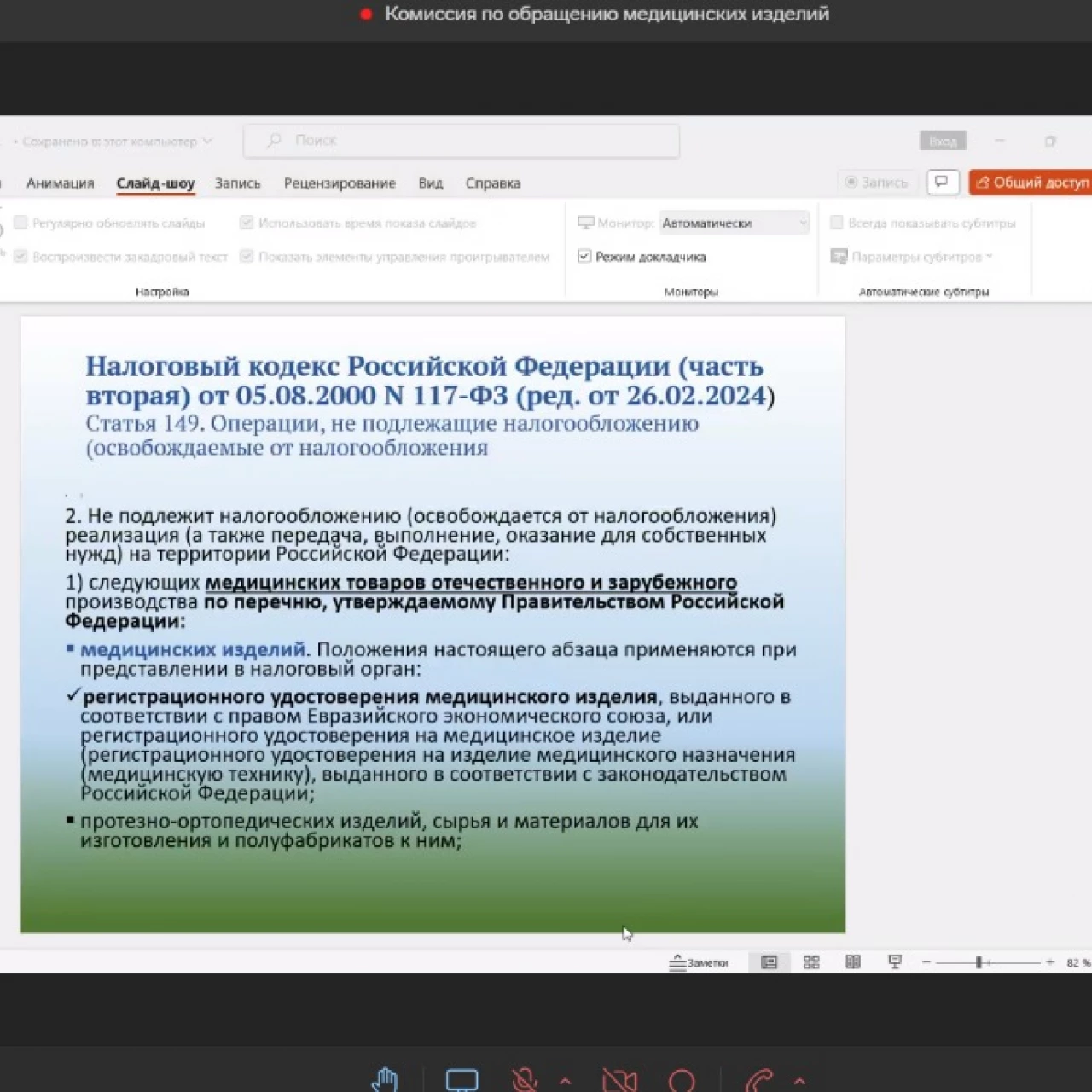
При обсуждении вопроса о применении льготной ставки НДС для МИ были продемонстрированы расчеты, характеризующие увеличение операционных затрат поставщиков МИ, а также надзорной нагрузки со стороны ФНС и ФТС. Кроме того, было сообщено, что обращение на рынке идентичных МИ с различной ставкой НДС и многозначность толкований классификаторов видов МИ приводит к рискам нарушения антимонопольного законодательства и к возникновению штрафов. При этом изменение цен и ставок НДС на МИ ведет к увеличению расходной части статей государственного бюджета на медицинские услуги, а, так как медицинские организации не являются плательщиками НДС, его доходная часть не пополняется.
Принимая во внимание неоднозначность толкований применения ставки НДС на МИ различными участниками сферы обращения МИ, участники заседания предложили подготовить аналитическую записку, организовать ее широкое обсуждение с сообществом производителей МИ, консультациями с регуляторами и последующим представлением в Минфин РФ.
По вопросу реализации положений Постановления Правительства РФ от 25.11.2023 г. № 1993 «О проведении на территории Российской Федерации эксперимента по маркировке средствами идентификации отдельных видов радиоэлектронной продукции» в части маркировки комплектующих и запасных частей для МИ представители сообщества медицинской индустрии высказали опасения в неоправданности расходов, связанных с закупкой дорогостоящего оборудования для маркировки компонентов МИ. Бизнес пояснил: так как объемы комплектующих и запасных частей для МИ, подлежащих маркировке, незначительны, а сами изделия уникальны, вероятность их фальсификации минимальна.
Представитель Минпромторга России объяснил, что это только эксперимент, в процессе которого будут учитываться мнения отрасли. Было предложено в ходе эксперимента проводить мониторинг с привлечением представителей сообщества производителей МИ.
В части вопроса по регистрации МИ в соответствии с Правилами ЕАЭС представители отрасли МИ сообщили о незначительном числе зарегистрированных изделий, большом количестве отказов, в том числе после подачи повторных заявлений. Кроме того, учитывая высокую стоимость затрат по регистрации и очень низкую вероятность получения регистрационного удостоверения, отмечается снижение заинтересованности заявителей к евразийскому треку регистрации.
Вместе с тем, Росздравнадзор отметил низкое качество подготовки документов со стороны заявителей, однако, несмотря на имеющиеся сложности, призвал заявителей продолжать регистрироваться по Правилам ЕАЭС.
Представители отрасли отметили, что в складывающейся ситуации вероятность успешного своевременного перехода на единые Правила регистрации и экспертизы безопасности, качества и эффективности медицинских изделий в рамках ЕАЭС до конца 2025 года весьма невысока, и предложили выйти с инициативой о дальнейшем продлении переходного периода после 31 декабря 2025 года, в течение которого в странах-членах ЕАЭС могут параллельно продолжать действовать как евразийские Правила регистрации МИ, так и национальные Правила регистрации МИ.
Также в рамках заседания было предложено рассмотреть вопрос о введении механизма упрощенной перерегистрации МИ по Правилам ЕАЭС, которые ранее уже были зарегистрированы и успешно обращаются в странах-членах ЕАЭС по национальным правилам.
Запись заседания можно посмотреть по ссылке.